Schwachstellen von Krebszellen ausfindig machen
Züricher Wissenschaftler haben unzählige genetische Wechselwirkungen untersucht und auf diese Weise das komplexe Netzwerk von DNA-Reparaturwegen aufgedeckt – als Ansatzpunkt für neue Krebstherapien.
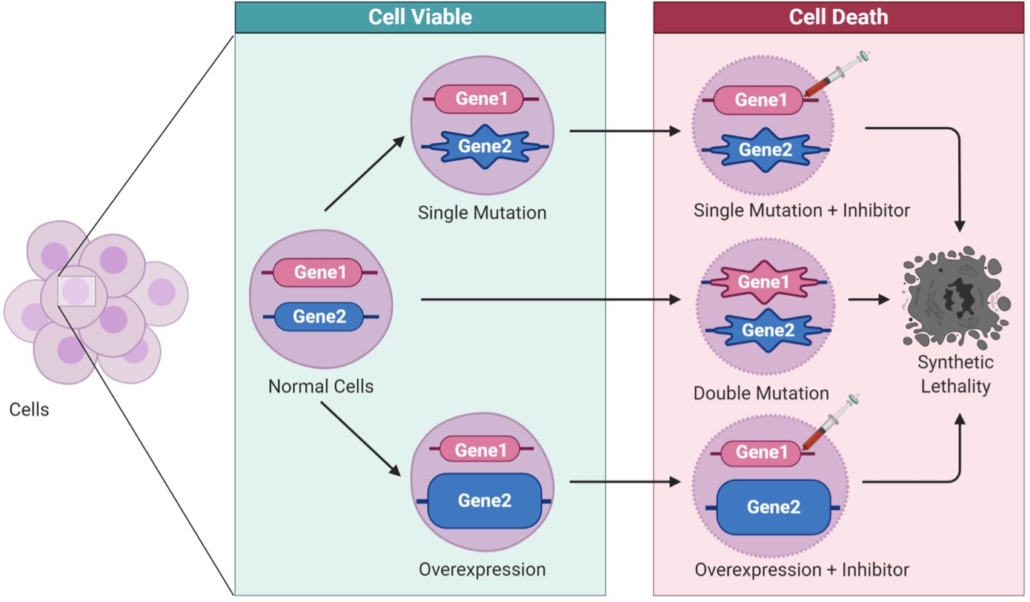
Mehr als 500 Gene sind für die Reparatur von DNA-Schäden zentral. Wie diese Gene wechselwirken, hat ein Forschungsteam um Jacob Corn von der ETH Zürich nun umfassend analysiert. Die in der Studie in Nature identifizierten gegenseitigen Abhängigkeiten offenbaren nicht nur, wie Zellen ihr Genom intakt halten. Sie zeigen auch mögliche neue Angriffspunkte für eine gezielte Krebstherapie.
Wird ein Gen inaktiviert, übernimmt oft ein anderes Gen die fehlende Funktion. Um die Wechselwirkungen zu untersuchen, schalteten die ETH-Forscher daher jeweils zwei der 548 Reparaturgene gleichzeitig aus. Für diesen Ansatz der synthetischen Lethalität nutzten sie gentechnisch veränderte humane Zellen. „Menschliche Zellen lieben Redundanz“, erklärte Corn. „Wir sind systematisch vorgegangen und haben uns alle möglichen Kombinationen angesehen.“ Insgesamt fast 150.000 verschiedene Kombinationen musste der ETH-Professor, der mit seinem Team die Genomeditierung optimiert, dabei untersuchen. Dafür wurde ein „CRISPRi dual guide screening“ eingesetzt, welches die gleichzeitige Expression von zwei single guide RNAs (sgRNAs) in humanen RPE-1-Zellen erlaubt. Erst durch den Verlust des Backups verlieren die Zellen die Fähigkeit zur DNA-Reparatur. Bei etwa 5.000 inaktivierten Genpaaren ließ sich beobachten, dass die Zellen daraufhin durch die sich ansammelnden Schäden abstarben.
Für zwei solcher Genpaare deckte das Forschungsteam bisher unbekannte Verbindungen und gemeinsame Mechanismen auf: WDR48-USP1 und FEN1/LIN1 sowie FANCM und SMARCAL1. Die Enzyme FANCM und SMARCAL1 lösen gemeinsam instabile DNA-Kreuzstrukturen auf, welche die DNA-Reparatur behindern. Die Deubiquitinase USP1 und ihr Aktivator WDR48 wiederum schützen während der Replikation den zentralen Faktor PCNA vor Abbau. Sie sind für den Vorgang daher ebenso unverzichtbar wie die Enzyme FEN1 und LIN1.
Tausende weitere Verbindungen warten nun darauf, eingehender untersucht zu werden. Damit werden sich weitere Schwachpunkte in der DNA-Reparatur offenbaren, die für die Krebstherapie von Bedeutung sein könnten. „Wir haben aufgezeigt, welche Wege durch den dunklen Wald führen“, so Corn. „Jetzt ist es ein Leichtes, diese Wege abzuschreiten.“
Das Konzept der synthetischen Letalität wird am besten durch Poly-ADP-Ribose-Polymerase-(PARP)-Inhibitoren veranschaulicht, die auf Tumoren abzielen, die einen Defekt in der homologen Rekombinations-DNA-Reparatur aufweisen. Dazu sind schon Wirkstoffe zugelassen worden. Nun werden immer neue und weitere Kombinationen untersucht.
Die Eisbach Bio GmbH aus Planegg entwickelt auf dieser Basis bereits Kombinationstherapien: Inhibitoren gegen ALC1 etwa sollen gezielt die Schwachstelle von Tumorzellen mit defizienter homologer Rekombination ausnutzen und werden in der Phase I/II-Studie MATCH klinisch getestet. Die Schweizer Debiopharm und Repare Therapeutics aus Kanada wiederum haben kombinierte Inhibitoren gegen die Kinasen PKMYT1 und WEE1, die gemeinsam gegen den Zellzyklusregulator CDK1 wirken, in die Phase I/Ib-Testung in der MYTHIC-Studie gebracht. Die niederländische Tesselate Bio verfolgt zwei Wege neue Schwachstellen in der Tumorzelle zu identifizieren: einmal setzt das junge Unternehmen an den Telomeren an. In gesunden Zellen verkürzen sich die Telomere mit jeder Zellteilung, was die Anzahl möglicher Teilungen begrenzt. Krebszellen überwinden diese Telomerverkürzung – und damit die Teilungsgrenze – durch verschiedene Mechanismen. Einer davon ist die Alternative Telomerverlängerung (ALT), die eine unbegrenzte Zellvermehrung ermöglicht. In einem anderen Schwerpunkt gehen die Niederländer eine „Loss of function“ der Krebszelle an: Das Tumorsuppressorgen RB1 spielt eine zentrale Rolle bei der Koordination verschiedener zellulärer Prozesse in Krebszellen – darunter Zellvermehrung, DNA-Schädigung, Zellzyklus und Apoptose. Der Verlust der RB1-Funktion ist eine häufige Veränderung bei verschiedenen soliden Tumoren und tritt besonders oft in aggressiven und metastasierenden Krebsarten auf. Nun ist die deutsche Pharmafirma Boehringer Ingelheim auf Tesselate Bio aufmerksam geworden und hat eine millionenschwere Kooperation geschlossen.

 Panagopoulos et al.
Panagopoulos et al. Dong-Jiunn Jeffery Truong
Dong-Jiunn Jeffery Truong Astrojan via Wikimedia Commons, CC BY-SA 4.0
Astrojan via Wikimedia Commons, CC BY-SA 4.0